|
Адиабатным или изоэнтропийным называется равновесный процесс протекающий без обмена энергией в тепловой форме между газом (термодинамической системой) и окружающей средой. В адиабатном процессе термодинамическая система и окружающая среда могут обмениваться энергией, но не в форме теплоты. Следовательно, в адиабатном процессе энергия в форме теплоты к рабочему телу не подводиться и не отводится от него.
Основное условие протекания адиабатного процесса Q=0. в принципе, понятие об адиабатном процессе можно отнести к разряд термодинамических идеализаций, поскольку в реальности не возможно обеспечит условия при которых теплообмен был бы полностью исключен. Но, применяя эффективную тепловую изоляцию рабочего тела от окружающей среды, можно свести к минимуму теплообмен, а незначительными тепловыми потерями пренебречь.
Несмотря на предпосылку о равновесности, в дальнейшем будем относить к адиабатным процессам и те процессы, которые протекают настолько быстро, что вследствие тепловой инерции системы изменения состояния, связанного с теплоотдачей на границах, практически не наблюдается.
Уравнение адиабатного процесса в V-p-координатах может быть получено, если использовать выражение первого закона термодинамики и учесть отдельные особенности идеального газа.
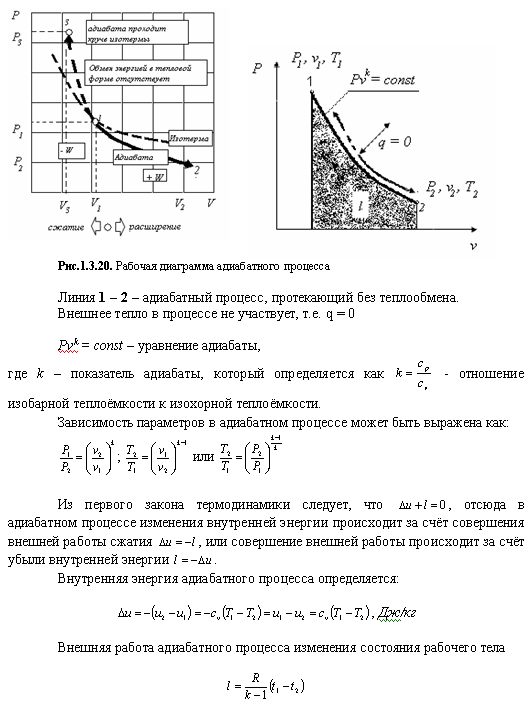
Схема энергического баланса для адиабатных процессов расширения и сжатия показана на рис.1.3.22 эти схемы иллюстрируются основное содержание понятия адиабатного процесса.
 Обмен энергией в механической форме (путём совершения работы) Обмен энергией в механической форме (путём совершения работы)между термодинамической системой и окружающей средой приводит к изменению только её внутренней энергии.
Поскольку в адиабатном процессе энергия в форме теплоты к системе не подводиться и не отводиться от неё, то говорить о доле тепловой энергии расходуемой на изменение внутренней энергии системы (идеального газа), в этом процессе не имеет смысла.
Таблица1.3.1
Соотношение между параметрами состояния идеального газа в простейших термодинамических процессах
|
Термодинамический процесс
|
Соотношение
|
|
Изохорный (V=соnst; dV=0)
|
p/T= соnst
|
|
Изобарный (p=соnst; dp=0)
|
V/T= соnst
|
|
Изотермический (T=соnst; dT=0)
|
pV= соnst
|
|
Адиабатный (Q=0)
|
pVk= соnst
|
|
|
TVk-1= соnst
|
|
|
|
|