|
Все вы знаетефундаментальный закон природы, который гласит - энергия не исчезает и не возникает вновь, она лишь переходит из одного вида в другой при протекании того или иного физического или химического процесса. Это закон сохранения и превращения энергии носит всеобщий характер.
В рамках технической термодинамики закон сохранения и превращения энергии утверждает: для любой закрытой системы количество энергии, заключенное в этой системе, сохраняется неизменным.
Напомним, что закрытой термодинамическая система бывает тогда, когда она не обменивается с окружающей ее средой ни теплотой, ни работой, ни веществом.
Первый закон термодинамики является частным случаем закона сохранения и превращения энергии.
Математическая формулировка первого закона термодинамики может быть получена на основании следующих рассуждений, опирающихся на рассмотренные ранее положения.
Известно, что если температура повышается, объем тела увеличивается и соответственно увеличивается внутренняя энергия. В свою очередь, при увеличении объема тела производится внешняя работа (работа по выталкиванию поршня из цилиндра).
Если обозначить количество теплоты, подведенное к телу при нагревании от состояния 1 до состояния 2, Q, изменение внутренней энергии ∆u,а совершенную телом работу против внешнего давления L, то на основании закона сохранения и превращения энергии можно записать:
Q = ∆u + L , Дж
q = (u2 – u1) + l, Дж/кг - удельная теплота
q = сv (Т2 – Т1) + l, , Дж/кг - удельная теплота
Единица измерения теплоты и работы одинакова. Потому что теплота и работа – это энергетические характеристики механического взаимодействия системы с окружающей средой.
По закону сохранения энергии теплота и работа эквивалентны друг другу.
Уравнение является уравнением первого закона термодинамики в самом общем виде. Оно в математическом виде раскрывает физический смысл первого закона термодинамики.
Первый закон термодинамики - теплота, сообщаемая системе, идет на приращение ее внутренней энергии и на совершение внешней работы.
Из уравнения можно сделать вывод, что и работа L и количество теплотыQ зависят от характера процесса. Другими словами, работа является функцией процесса. Это же относится и к количеству теплоты в силу принципа эквивалентности теплоты и работы.
В отличие от теплоты и работы, величина внутренней энергии тела (или системы) определяется только его конечным состоянием и не зависит от характера термодинамического процесса, т. е. от характера пути, по которому система перешла от состояния 1 к состоянию 2.
Это означает, что величина, на которую изменяется внутренняя энергия системы в любом термодинамическом процессе, равна разности величин внутренней энергии в начальной и конечной точках этого процесса рис.1.3.1
Заметим, что знаки величин, входящих в последнее уравнение, могут быть различными, но в технической термодинамике для соблюдения единообразия принята следующая система знаков: теплота, подводимая к системе со стороны окружающей среды, считается положительной, отводимая от системы в окружающую среду — отрицательной.
Для работы принята другая система знаков: работа, совершаемая над системой (т.е. работа, затрачиваемая на сжатие газа), считается отрицательной, а работа, совершаемая системой (производимая системой), наоборот — положительной. В технических системах это — работа, совершаемая газом при его расширении.
Как видно из рис. 1.3.1 работа расширения газа (равно как и сжатия), зависит от пути, по которому система переходит из начального состояния в конечное. Другими словами, работа является функцией процесса. Это же относится и к количеству теплоты в силу принципа эквивалентности теплоты и работы. В отличие от теплоты и работы, величина внутренней энергии тела (или системы) определяется только его конечным состоянием и не зависит от характера термодинамического процесса, т. е. от характера пути, по которому система перешла от состояния 1 к состоянию 2. Это означает, что величина, на которую изменяется внутренняя энергия системы в любом термодинамическом процессе, равна разности величин внутренней энергии в начальной и конечной точках этого процесса.
Поэтому с целью наглядного представления энергетического баланса некоторого процесса можно принять следующие символические условия:
если стрелка внутри знака «система» направлена вверх (рис. 1.3.2), внутренняя энергия системы увеличивается;
если стрелка направлена вниз — внутренняя энергия системы уменьшается;
если стрелка внутри знака «система» имеет горизонтальное направление, внутренняя энергия системы не изменяется.
Следует обратить внимание на то, что хотя величины, входящие в уравнение первого закона термодинамики (внутренняя энергия U,работа Lи количество теплоты Q)выражаются в одних и тех же единицах энергии, физические понятия, определяющие эти величины, глубоко различны. Как уже отмечалось ранее, внутренняя энергия представляет собой энергию, накопленную рабочим телом (системой) в виде хаотического движения мельчайших частиц (сумма кинетических энергий хаотического движения всех частиц системы), а работа и теплота характеризуют энергию, которая подводится к системе или отводится от нее в каком-либо процессе.
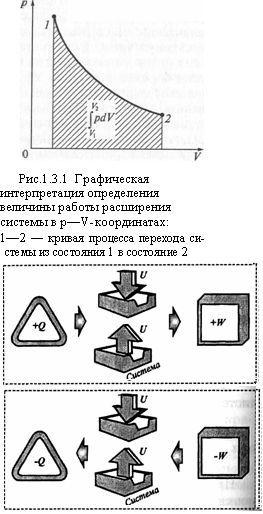
Рис. 1.3.2 Условная схема обмена энергией термодинамической системы с окружающей средой
Термодинамическая система характеризуется рядом величин.
Величина, которая однозначно определяется только состоянием системы и не зависит от того, как пришла система в данное состояние из любого другого, называется, как было отмечено ранее, функцией состояния термодинамической системы.
Величина, значение которой определяется тем, каким образом термодинамическая система пришла в свое конечное состояние, называется функцией процесса.
Теплота и работа являются функциями процесса. В технической термодинамике важнейшими функциями состояния являются внутренняя энергия и энтальпия.
Поскольку понятие внутренней энергии было уже рассмотрено, остановимся на понятии энтальпии. Пусть в закрытом сосуде содержится газ, имеющий давление Р, Па (Н/м2).
Следовательно, с энергетической точки зрения давление Рпредставляет собой потенциальную энергию давления газа, отнесенную к единице объема, т.е. объемную плотность потенциальной энергии давления. Если величина объема газа равна V, м3, то суммарный запас потенциальной энергии давления газа, заключенного в данный объем, равен произведению РV,Дж. Умножив величину давления Рна объем, занимаемый единицей массы, т.е. на удельный объем v, м3/кг, получим величину потенциальной энергии давления газа, отнесенную к единице массы газа pv, Дж/кг. Величинаpv представляет массовую плотность потенциальной энергии давления газа.
Энтальпия, Н, Дж, представляет собой полную энергию массы газа, т. е. сумму внутренней энергии и потенциальной энергии давления:
Н= U+pV
.
Энтальпия, отнесенная к единице массы газа, имеющего давление р, называется удельной массовой энтальпией h, Дж/кг:
h = и + pv.
Поскольку в выражении для энтальпии входят величины U,Р,V, которые являются функциями состояния, следовательно, и сама энтальпия также является функцией состояния. Изменение энтальпии в любом процессе определяется только начальным и конечным состоянием тела и не зависит от характера процесса.
|