|
Интенсивность горения характеризуется скоростью реакции. Под скоростью гомогенной реакции понимают массовое количество вещества, реагирующее в единице объема в единицу времени.
Скорость гетерогенной реакции выражают количеством вещества, реагирующего на поверхности твердого горючего.
В области I (рисунок 1.6) при рассматриваемой температуре скорость химической реакции ниже скорости смесеобразования и результирующая скорость горения определяется скоростью химической реакции. Кинетическое горение наблюдается при низких температурах в зоне горения. При высоких температурах оно может протекать при очень интенсивном смесеобразовании.
В области III скорость смесеобразования, определяемая линиями 2 меньше скорости химической реакции. Диффузионное горение наблюдается при высоких температурах в зоне горения. При медленном смесеобразовании оно возможно и при 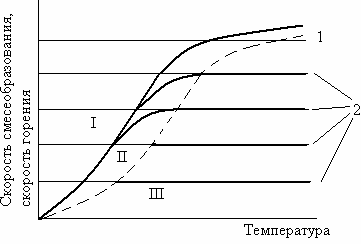 низких температурах.
Рисунок 1.6 – Зависимость скорости горения и смесеобразования от температуры
Горение при условии, когда скорость химической реакции и скорость смесеобразования равны, называется промежуточным (II область).
Скорость протекания химических реакций и положение равновесия зависит от химической природы реагирующих веществ, концентрации реагирующих веществ и физических условий (температуры, давления).
В однородной среде при Т=const скорость химической реакции пропорциональна произведению концентраций реагирующих веществ.
 где k – константа скорости реакции, зависящая от температуры и химической природы, реагирующих веществ; СА, CB, CM, CN – текущие концентрации реагирующих веществ, моль/м 3; a, b, g, d - стехиометрические коэффициенты, показывающие число молей веществ, участвующих в реакции. В условии гетерогенного горения концентрация горючего (твердого топлива) неизменна, поэтому скорость такой реакции будет зависеть только от концентрации окислителя (кислорода) у поверхности топлива
Wp=kCпо2,
где Cпо2–концентрации кислорода у поверхности топлива.
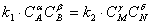 Химическое равновесие описывается уравнением: Константа равновесия определяется из уравнения:
В условиях промышленного сжигания топлива обычно состояние равновесия не наступает. Скорость реакции можно определить по скорости превращения любого из реагентов, поэтому скорость сгорания топлива можно выразить через скорость расходования горючих элементов или топлива в целом, а также через скорость расходования окислителя или скорость образования продуктов сгорания.
Зависимость скорости химической реакции от температуры
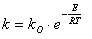 С увеличением температуры скорость химической реакции горения возрастает. Для нахождения зависимости скорости химической реакции от температуры достаточно определить температурную зависимость константы. Эта зависимость выражается законом Аррениуса.
где Е – энергия активации (кДж/моль), R – газовая постоянная (8,314 кДж/моль), kо – предэкспоненциальный множитель (общее число столкновений молекул), Т – абсолютная температура процесса.
Энергия достаточная для разрушения внутримолекулярных связей исходных веществ, называется энергией активации Е. Чем выше уровень энергии активации, тем медленнее скорость реакции.
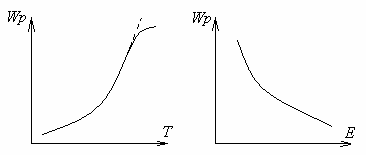 Так, энергия активации реакции С+О 2=СО 2 – ЕСО2=140 кДж/моль, а реакции С+1/2О2=СО –Есо=60 кДж/моль. Отсюда следует, что в реакции окисления углерода кислородом скорость образования окиси углерода СО значительно выше, чем образования двуокиси СО2, и количество СО у поверхности горящего углерода будет преобладать.Рисунок 1.7 – Зависимость скорости реакции от температуры и энергии активации
Энергия активации является главным фактором, определяющим скорость реакции: чем меньше энергия активации, тем выше скорость.
Зависимость скорости химической реакции от концентрации смеси
 В топочных устройствах горение происходит при постоянной подаче топлива и окислителя в зону горения и, следовательно, при постоянной концентрации реагирующих веществ.
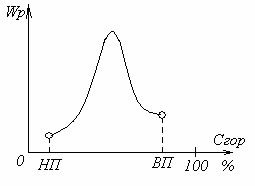
Рисунок 1.8 – Зависимость скорости химической реакции от концентрации горючего в смеси
При избытке горючего или при малой его концентрации (его недостаче) скорость реакции снижается из-за уменьшения тепловыделения на единицу объёма.
Горение может происходить не при любой концентрации горючего в смеси, а лишь в определенном соотношении с воздухом. Существует нижний предел концентраций горючего (НП), ниже которого горение невозможно, и верхний предел концентраций (ВП), когда дальнейшее увеличение горючего также приводит к прекращению горения. Во всём диапазоне концентраций между этими пределами горение возможно.
|